Nachtschicht im Meerwasseraquarium

Neuste Erkenntnisse aus der Forschung: Wissenschaftler identifizierten kürzlich ein Gen, dass das Wachstum von SPS Korallen ankurbelt, sobald es Nacht wird.
Ein Bericht von Dieter Kreißl
Der folgende Artikel gibt einen tieferen Einblick über das Wachstum von Steinkorallen vornehmlich der SPS und verweist auf die neusten Forschungsergebnisse in diesem Umfeld. Wie allerseits bekannt sein dürfte, wird das Kalkskelett außerhalb der Korallenpolypenzelle gebildet und lässt sich zurückführen auf die Kalkfällung: Wenn in einer Lösung Calciumionen und Hydrogencarbonationen („Karbonathärte“) vorliegen und der pH-Wert sich ins Alkalische verschiebt, wird ein Teil des Hydrogencarbonats in Carbonat umgewandelt. Carbonat ist aber nicht besonders gut löslich und bei Überschreiten des Löslichkeitsproduktes muss ein Teil des Carbonats aus der Lösung verschwinden und setzt sich zusammen mit Calcium als Kalk ab.
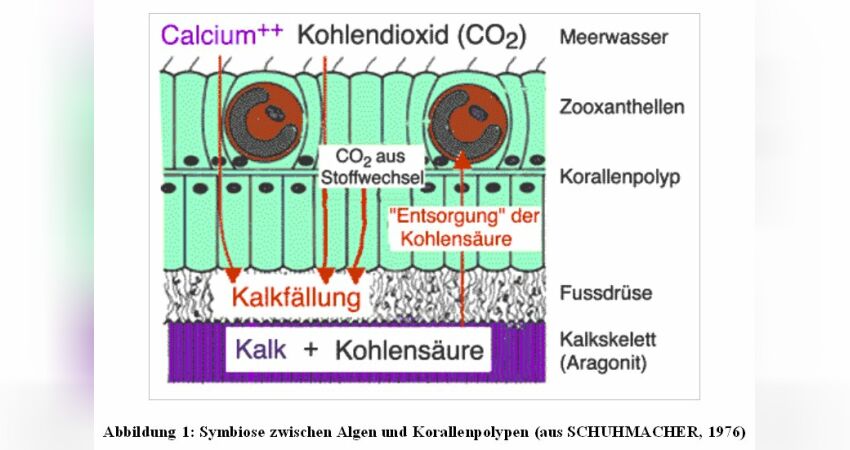
Die Abbildung 1 zeigt den schematischen Schnitt durch eine Steinkoralle zur Veranschaulichung der Kalksynthese. Die Kohlensäure, die bei der Kalkfällung entsteht, würde den Kalk gleich wieder auflösen, wenn die Zooxanthellen das CO2 nicht in der Photosynthese "entsorgen" würden. Die Kalksyntheserate wäre um ein Vielfaches geringer und die Korallen könnten nicht wachsen bzw. ihr Kalkskelett aufbauen.
Wie schnell nun das Kalkskelett wächst, hängt von einer Reihe von Faktoren ab: sind symbiontische Algen (Zooxanthellen) vorhanden oder nicht, Lichtstärke und -dauer, Lichtspektrum, Temperatur, Calcium- und Hydrogencarbonatkonzentration, pH-Wert, Nitrat, Phosphat, Strömungsverhältnisse, Spurenelementversorgung, allgemeine Konstitution und Stresszustand des Tieres und natürlich spielt die Korallenart eine wichtige Rolle.
Der Korallenpolyp kann diesen Vorgang beschleunigen, indem er schnell Hydrogencarbonat durch das Enzym Carboanhydrase bildet und andererseits den pH-Wert an der Kalkbildungsstelle hoch hält. Carboanhydrase (CA) ist ein Enzym, das die physiologisch bedeutsame Gleichgewichtsreaktion
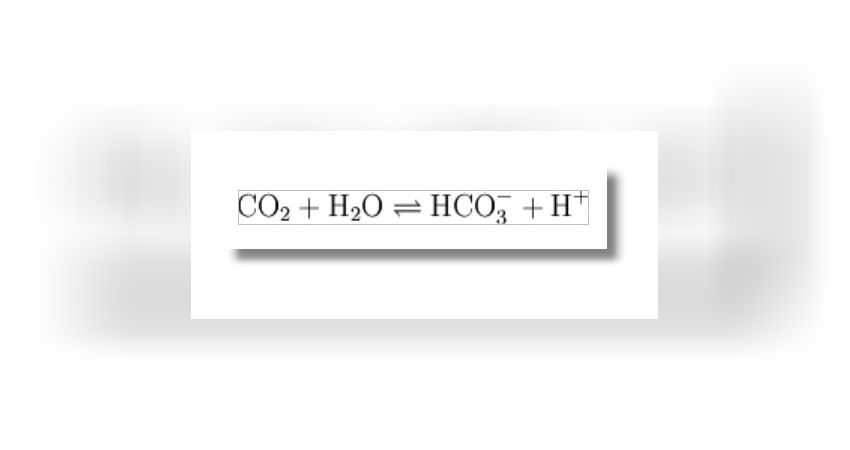
katalysiert. Diese Methode ist die einzige Möglichkeit des empfindlichen Korallenpolypen sich in der Nacht gegen die beim Kalkskelettbau anfallenden Säuren zu schützen.
CA besteht aus einem Protein und enthält als Cofaktor ein Zinkion (Zn2+), welches die eigentliche katalytische Aktivität des Enzyms bedingt. Nebenbei bemerkt ist die Carboanhydrase eines der schnellsten bekannten Enzyme. Schon seit längerem war bekannt, dass das Skelettwachstum dabei nachts am stärksten ist. Die molekularen Mechanismen hinter dieser Steuerung waren bislang ungeklärt. Französische Forscher haben nun ein Gen mit dem Namen STPCA in der Koralle isoliert, dessen Aktivität dem Lichtzyklus unterworfen ist. STPCA steuert die Bildung dieses Enzyms, das mit Hilfe von Kohlendioxid Bikarbonate aufbaut und damit eine wichtige Rolle beim Korallenwachstum spielt. Das Gen reagiert auf den Hell-Dunkel-Zyklus des Tageslichts und dient damit als Zeitgeber. Die höchsten Konzentrationen des Enzyms entdeckten die Wissenschaftler in der wässrigen Schicht direkt unter dem Kalkskelett der Korallen, hier war es in der Nacht doppelt so hoch wie am Tage. Nachts ist dieses Gen doppelt so aktiv wie tagsüber.
Die Kalkproduktion setzt viele Protonen frei, die das Milieu rund um die Koralle ansäuern, was wiederum das Skelett angreift. Tagsüber schaffen die Algen diese Protonen während der Photosynthese heraus, nachts muss das Bikarbonat sie abpuffern, damit die Koralle keinen Schaden nimmt. Die Koralle produziert daher vermehrt Bikarbonat, das als Puffer wirkt und die Säurewirkung neutralisieren kann.
In Versuchen setzten die Forscher Korallen einem Hemmstoff gegen dieses Enzym aus und tatsächlich sank die Rate der Skelettbildung als Reaktion. Damit war die direkte Rolle von STPCA für das Korallenwachstum in der Nacht bestätigt.

Die Tests wurden an der symbiontisch lebenden Koralle Stylophora pistillata (Abb. oben) durchgeführt.
Die Grundvoraussetzung, das diese Katalyse optimal funktioniert, ist die Existenz des Metall Zink. Dies erklärt auch das Phänomen, das in Aquarien mit erhöhter Zinkkonzentration das Wachstum der Steinkorallen stärker als in der Natur ist. Damit Zink im Meerwasseraquarium vorhanden ist, muß wie jedem bekannt, der Phosphatgehalt im Wasser so niedrig wie möglich gehalten werden, da das Phosphat aus den Spurenelementen wie Zink, Eisen und Kupfer natürliche Phosphate bildet und dies die katalytische Aktivität unterbindet.
Wissenswertes über Zink (Zn)
Zink ist von Natur aus im Meerwasser enthalten, wobei die mittlere Konzentration von Zink bei circa 0,6-5 ppb liegt. Algen enthalten 20-700 ppm, Meeresfische und Muscheln 3-25 ppm, Austern 100-900 ppm und Krebse 7-50 ppm. (ppb = „parts per billion“ = 10−9 = Teile pro Milliarde; 1 ppm = 10−6 = Teile pro Million = 0,0001 % oder 1 mg/L)). Die Angaben erfolgen in mg/L, die Einheit ppm (parts per million) ist gleichbedeutend und hauptsächlich im englischen Sprachraum verbreitet.
Hinweis: Die Weltgesundheitsorganisation WHO (World Health Organisation) hat einen Trinkwassergrenzwert für Zink von 5 mg Zn2+/L festgelegt.
Wasserlöslichkeit von Zink und seinen Verbindungen
Die Wasserlöslichkeit von elementarem Zink ist nicht nur abhängig von der Temperatur, sondern auch vom pH-Wert des Wassers. Im neutralen Bereich ist Zink fast unlöslich, während die Löslichkeit bei einem pH-Wert von 6 oder kleiner rapide steigt und auch ab pH 11 wieder zunimmt. Zink ist in Meerwasser in etwa hundertfach größerer Konzentration löslicher als Kupfer, wobei hier nicht das Hydroxid, sondern das Carbonat die Löslichkeit bestimmt.
Das Element liegt im gelösten Zustand als ZnOH+ oder als Zn2+ vor. Genau dieses Zn2+ wird für die oben erwähnte katalytische Aktivität bei der Carboanhydrase herangezogen. Auch die Form des nichtionischen Zinkcarbonat ZnCO3 (Löslichkeit 0,21 g/L) ist anzutreffen.
Beispiel für eine Zinkverbindung, die in Wasser gut löslich ist, ist Zinkchlorid (ZnCl2) mit einer Wasserlöslichkeit von 4320 g/L. Zinkchlorid ist sehr hygroskopisch (wasseranziehend). Siehe Abb.3 .

VORSICHT: Bitte unbedingt die sehr niedrige Konzentration des Zinkanteils im natürlichen Mehrwasser von 0,01 mg/L beachten!!!
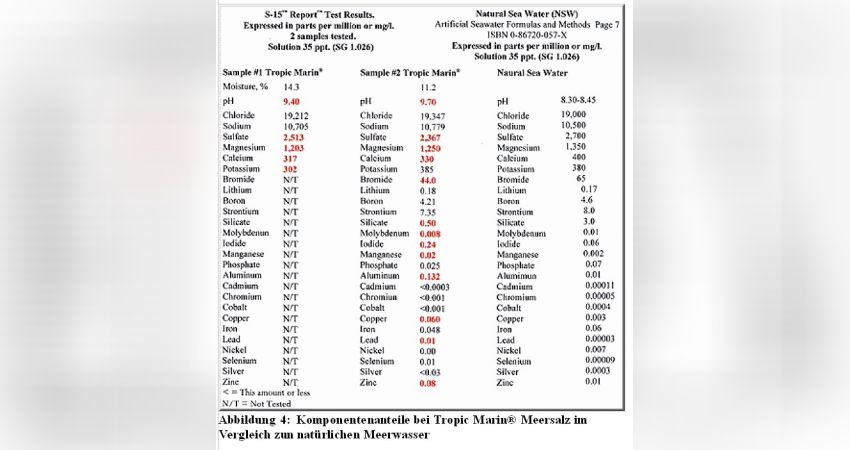
Der einfachere Weg für diejenigen Meerwasseraquarianer unter uns, welcher mit dem Umgang von Chemikalien unsicher sind, ist die Verwendung von Meersalzmischen wie z.B. Tropic Marin®, dessen Zinkgehalt achtmal höher ist als des Gehaltes im Meerwasser, nachdem das Tropic Marin® Meersalz angesetzt wurde (Abb. 4). Der Zinkgehalt im Meerwasseraquarium sollte aber dringenst am Anfang getestet werden.
Quantitative Maßanalyse von Zink (Zn2+)
Um den Zinkgehalt quantitativ zu messen, wird die sog. Komplexometrie durchgeführt. Bei diesem Verfahren der Maßananalyse werden in Lösung befindliche Metallionen mit organischen Komplexbildnern quantitativ umgesetzt, d.h. der Ligand bildet mit dem zu bestimmenden Metallion Zn2+ohne Nebenreaktionen einen beständigen Komplex, woraus auf die Konzentration des Metallions zurückgeschlossen werden kann.
Welche Wasserreinigungstechnologien können genutzt werden, um Zink zu entfernen?
Um Zink aus Wasser zu beseitigen, können verschiedene Methoden angewandt werden. Für normale Anwendungen sind Ionenaustauscher oder Aktivkohle ausreichend. Als sehr effektiv gilt die Verwendung von Sandfiltern.
Ich hoffe mit diesem Artikel einen interessanten chemisch-biologischen Aspekt dargestellt zu haben. Diese Erkenntnisse nun genauer zu betrachten und mit den Erfahrungen in unseren Meerwasseraquarien zu vergleichen, ist nun Aufgabe von uns allen Meerwasseraquarianer.
Dieter Kreißl
Literaturhinweise:
- Schumacher H. (1976), Korallenriffe; BLV-Verlagsgesellschaft München – FRG
- http://www.jbc.org/cgi/content/abstract/283/37/25475
- J Biol Chem. 2008 Sep 12;283(37):25475-84. Epub 2008 Jul 10
- Gianguzza, A. e.a., 2002. Chemistry of Marine Water and Sediments. Berlin, Springer-Verlag
- http://www.chemiehtl.at/edu011/dokuzovic/Komplexometrie.pdf
Autor: Dieter Kreißl
Wie gefällt Ihnen dieser Artikel?
Infos
Autor

Lesezeichen
Kommentare
Themen
Ähnliche Artikel
- Erfahrungsbericht über die Nachzucht von Lithophyton arboreum
- Tropic Marin® Phos-Start & Tropic Marin® Phos-Feed
- Ernährung und Haltung von azooxanthellaten Gorgonien
- Neuigkeiten zur Pflege von Tubastrea
- Zu Besuch bei Whitecorals - die neue Korallenfarm
- Das Kleben von Gorgonien und Steinkorallen.
- Nährstoffarm oder nährstoffreich – nur Ansichtssache?
- Maxspect TrueReef Filter Lens für IPhones - Gouda Cheese
- Octocorallia - Achtstrahlige Korallen - Teil 2
- Acanthastreas, Micromussa, Änderung bei den Namen und neue Arten vorgestellt
Kommentare Zum Anfang
Bitte anmelden
Damit Sie selbst etwas schreiben können, müssen Sie sich vorher anmelden.







